【中和反応と塩】中和のグラフと酸・塩基の関係
中和滴定曲線において,酸・塩基の強弱の組み合わせがわかりません。詳しく教えてください。
進研ゼミからの回答
こんにちは。いただいた質問について回答します。
【質問内容】
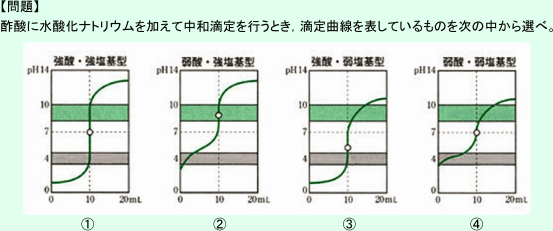
という問題について
酸・塩基の強弱とその中和滴定における滴定曲線の区別についてですね。
【質問への回答】
滴定曲線を見分けるポイントは,酸が弱い場合,中和点までに達する前の曲線の変化は緩やかになり,塩
基が弱い場合は中和点以降の曲線の変化は緩やかになるということです。このことをしっかり覚えておきま
しょう。
その理由は,弱い酸の場合,電離度が小さいため,中和点に達するまでの間に溶液を加えても,十分に水
素イオンが溶液中に電離していないことが影響しているためです。弱塩基についても同じことがいえます。
また,強塩基を用いて滴定した場合,中和点を超えたあと,pHが強塩基のpHに近づいていきます。
これにより,弱酸である酢酸を強塩基である水酸化ナトリウム水溶液で中和する場合,滴定曲線は,中和点
に達するまではpHが緩やかに上昇していきます。また,中和点を超えた後もどんどんpHが上昇していき,
もとの水酸化ナトリウム水溶液のpHに近づいていきます。このことより,②の曲線となります。
【学習アドバイス】
滴定曲線を見る際,
・滴定開始から中和点までの動き
・中和点におけるpH
・中和後に加え続けたときのpHの動き
がポイントとなります。
それぞれの特徴を押さえて取り組んでいきましょう。
これからもゼミの教材を活用し,力をつけていってください。