【中和反応と塩】塩の液性
塩を水溶液にすると酸性になるのか中性なのかそれとも塩基性になるのか,
どのように判断すればよいのか教えてください。
進研ゼミからの回答
こんにちは。いただいた質問について回答します。
【質問内容】

という問題について,
塩の水溶液の液性が物質によってそれぞれ異なっていることについてのご質問ですね。
【質問への回答】
それぞれについて水に溶かしたときのことを詳しく見てみましょう。
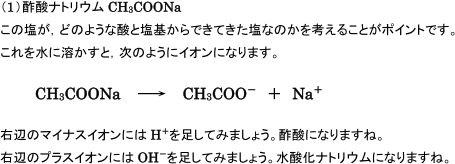
酢酸は弱酸,水酸化ナトリウムは強塩基です。このとき,「酢酸ナトリウムは弱酸・強塩基の塩である。」とい
います。そして,"弱酸・強塩基の塩"は,水溶液になったときには塩基性を示します。

塩酸は強酸,アンモニアは弱塩基です。このとき,「塩化アンモニウムは強酸・弱塩基の塩である。」といいま
す。そして,"弱酸・強塩基の塩"は,水溶液になったときには酸性を示します。
(1)と(2)から,塩の水溶液では,その塩が由来する酸や塩基を考えて,強い方の性質が表れると覚えてお
くとよいでしょう。
では,強酸・強塩基の正塩はどうでしょうか?
正解は,中性です。引き分けですね!!

【学習アドバイス】
正塩の水溶液の液性は,塩を構成する酸・塩基の強さによって決まります。
このことを頭において,強酸あるいは強塩基が含まれているかを確認するようにしましょう。
以上で回答を終わります。
これからも「進研ゼミ」の教材を利用して,力をつけていきましょう。