【中和反応と塩】中和反応と酸の強弱について
中和反応において,強酸も弱酸も同じ価数で同じ濃度であれば,同じ塩基に対して同じ量が反応するのはなぜですか?
弱い酸のほうは,あまり反応しないのではないのですか?
進研ゼミからの回答
こんにちは。いただいた質問について回答します。
【質問内容】

において,
同じ価数の酸でも,強酸と弱酸では中和に必要な量は変わるのではないか,というご質問ですね。
【質問への回答】
例えば,1.0mol/Lの水酸化ナトリウム水溶液に対して,1.0mol/Lの塩酸や1.0mol/Lの酢酸がどのように反応するか考えてみましょう。
①1.0mol/Lの塩酸10mLを1.0mol/Lの水酸化ナトリウム水溶液と中和滴定する場合
コニカルビーカーに1.0mol/Lの塩酸10mLを入れ,ビュレットに入れた1.0mol/Lの水酸化ナトリウム水溶液で滴定していきます。

1000×0.01=10〔mL〕
となります。
②1.0mol/Lの酢酸10mLを1.0mol/Lの水酸化ナトリウム水溶液と中和滴定する場合
(この時の酢酸の電離度を0.01とする)
今度は,コニカルビーカーに1.0mol/Lの酢酸10mLを入れ,ビュレットに入れた1.0mol/Lの水酸化ナトリウム水溶液で滴定していきます。

すると,この酢酸を中和滴定する場合,必要な水酸化ナトリウム水溶液の物質量は0.0001molとなるのでしょうか?
実際は違います。

1000×0.01=10〔mL〕
となり,変わりないことになります。
【学習アドバイス】
中和反応においては,中和の終点において酸・塩基の強弱にかかわらず,出しうる水素イオン,水酸化物イオンがすべて反応します。したがって
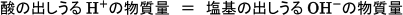
が成り立ちます。
このことをしっかり覚えておきましょう。
以上で回答を終わります。
今後も『進研ゼミ高校講座』を使って,得点を伸ばしていってくださいね。