【中和反応と塩】中和滴定による濃度の決定について計算式の意味がわかりません。
答えの, 1×y×5.00/100.0×5.00/1000=1×(0.10×1.75)/1000 において1は価数でyはモル濃度であることは分かるのですが, それ以降の式の数値の意味が分かりません。
進研ゼミからの回答
こんにちは。さっそく質問に回答しますね。
【質問の確認】
【問題】
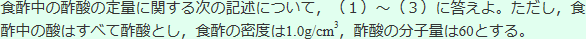
0.10mol/Lシュウ酸水溶液10.00mLをホールピペットを用いて正確にとってコニカルビーカーに入れ,指示薬を加えてから,ビュレットに入れた未知濃度の水酸化ナトリウム水溶液で滴定したところ,20.00mL加えたところで変色した。次に,ホールピペットで食酢5.00mLをとり,メスフラスコを用いて正確に100.00mLに希釈した。この水溶液5.00mLを上記の水酸化ナトリウム水溶液で滴定したところ,1.75mLで中和点に達した。
(1) 水酸化ナトリウム水溶液のモル濃度を求めよ。
(2) 希釈前の食酢中の酢酸のモル濃度を求めよ。
(3) 希釈前の食酢の質量パーセント濃度を求めよ。
の(2)について,
【解答解説】
(2)もとの食酢のモル濃度をy〔mol/L〕とすると、
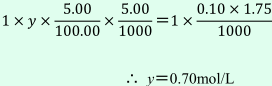
の計算式の立て方についてのご質問ですね。それでは一緒に考えていきましょう。
【解説】

では,この問題について考えてみましょう。
食酢中の酸はすべて酢酸です。
食酢の希釈前のモル濃度をy〔mol/L〕とします。
この食酢を5.00mLから100.00mLに希釈しています。

【アドバイス】
公式は丸暗記するのではなく,どのようにして公式が導かれたのかその意味を理解しておくことが重要です。
今後も『進研ゼミ高校講座』を使って,得点を伸ばしていってくださいね。