【反応熱】エネルギー図の見方
エネルギー図の見方がよくわかりません。何かコツがあれば教えてください。
進研ゼミからの回答
こんにちは。いただいた質問について回答します。
【質問内容】
エネルギー図の見方がよくわかりません。何かコツがあれば教えてください。
というご質問ですね。
【質問への回答】
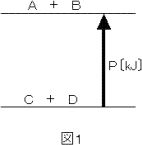
まずしっかり覚えておきたいのは,エネルギー図というのは,上に書かれている物質ほどもっているエネル
ギーが多いということです。下の図1では,Aという物質とBという物質のもつエネルギーの合計が,Cとい
う物質とDという物質のもつエネルギーの合計よりも,P[kJ]だけ多いことを示しています。
この図の関係を熱化学方程式に表すと,次のようになります。
C + D = A + B - P[kJ]
(ただしここでは,A,B,C,Dの物質が気体,液体,固体のどの状態であるかを示すのは便宜上省略してあ
ります)
つまり,これは,CとDという物質が反応するときに,P[kJ]の熱を得て,AとBという物質に変化しているこ
とを示しています。エネルギーの変化を示す矢印の向きがポイントになるのです。つまり,エネルギーの変化
を示す矢印が,(C+D)を出発点にし,(A+B)を終点にしていることが反応物と生成物を見分けるポイント
になります。
なお,熱量を示す数値の符号がマイナスなので,これは吸熱反応であることもわかります。なぜ,反応熱の
符号がマイナスになるか,疑問に思う人がいるかもしれません。
そのような人は,もう一度図1を見てみましょう。
前述のように,エネルギー図というのは高さによってエネルギーが多いか少ないかを表しているのでしたね。
図1を見ると,(A+B)のほうが(C+D)より上になっています。これは,つまり,(A+B)のほうが(C+D)よ
りP[kJ]だけエネルギーが多いことを示しています。
つまり,矢印の向きが上向きの反応は吸熱反応,矢印の向きが下向きの反応は発熱反応であることをしっ
かり理解しておきましょう。
【学習アドバイス】
熱化学の問題をエネルギー図を用いて解くとき,いくつかの反応が組み合わさって図が複雑になることがあ
ります。
そのときの基本は,上で説明したように反応前の状態と反応後の状態を比較し,上下関係を確認して反応熱
の正負を考えることです。このことに注意して問題に取り組むようにしましょう。
以上で回答を終わります。
今後も『進研ゼミ高校講座』を使って,得点を伸ばしていってくださいね。