【芳香族化合物の性質】芳香族化合物の異性体(オルト,メタ,パラ)
芳香族化合物の異性体に,オルト,メタ,パラという異性体があるそうですが,どのように区別すればいいのでしょうか?
進研ゼミからの回答
こんにちは。いただいた質問について回答します。
【質問内容】
芳香族化合物の異性体に,オルト,メタ,パラという異性体があるそうですが,どのように区別すればいいのでしょうか?
というご質問ですね。
【質問への回答】
ベンゼンの分子は,正六角形をしていて,炭素原子と水素原子がすべて同一平面上にあります。構造式では次のように書くことが多く,炭素原子間は単結合と二重結合が交互になっているように思いがちですが,実際は二重結合をつくる電子が6個の炭素原子間に均等に分布しており,特定の炭素原子間に二重結合が固定されているわけではありません。
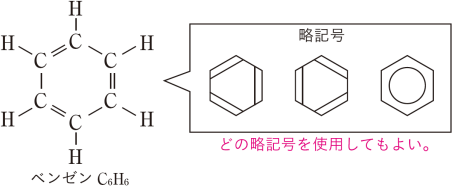
正六角形の各頂点には,1つずつ水素が結合しています。今,この水素のどこか1つを他の原子または原子団で置き換えるとします。
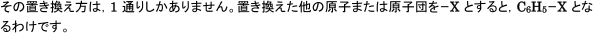
では次に,もう1箇所どこかの水素を他の原子または原子団に置き換えてみましょう。今度は何通りの置き換え方があるでしょうか?
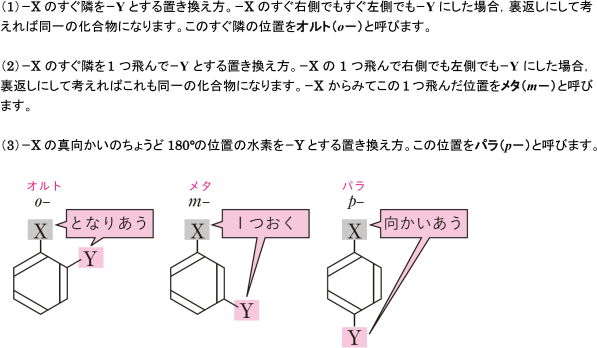
この場合,新しく置き換わる原子または原子団を-Yとすると,次の3通りになります。
【学習アドバイス】
ベンゼン分子中の2個の水素原子を,他の原子または原子団で置換した化合物には,上に示したように3種の構造異性体が存在します。説明では-Xと-Yを区別しましたが,この2つの置換基が同じ(-Xと-X)で あっても,構造異性体の種類は3種となります。それぞれ,位置を間違えないように覚えておきましょう。
以上で回答を終わります。
今後も『進研ゼミ高校講座』を使って,得点を伸ばしていってくださいね。