【化学結合】イオン化エネルギー,電子親和力とイオンのなりやすさについて
なぜイオン化エネルギーが小さいと陽イオンになりやすく,電子親和力が大きいほど陰イオンになりやすいんですか?
進研ゼミからの回答
こんにちは。いただいた質問について回答します。
【質問の確認】
・イオン化エネルギーが小さい原子ほど電子を放出しやすく,陽イオンになりやすい。
・電子親和力が大きいほど陰イオンになりやすい。
という説明について,どうしてそうなるのかを一緒にみていきましょう。
【解説】
物質のもつエネルギーはエネルギー図上の位置で表されます。これをエネルギーのレベルといいますが,物質はこのレベルが低い位置にあるほど安定な状態といえます。これがカギです。
イオン化エネルギーは原子から電子1個を取り去って,1価の陽イオンにするために必要なエネルギーで,原子が陽イオンになるときに吸収するエネルギーです。
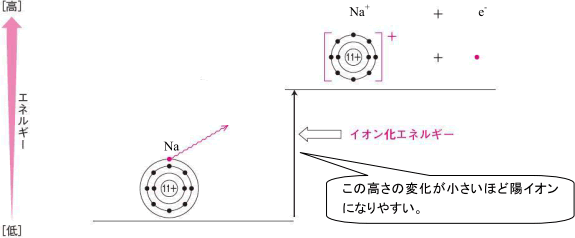
原子の状態からエネルギーを吸収してイオンになるのですが,このとき受け取るエネルギーが少ないほうがエネルギー図上でのレベルの上昇も少ないのです。エネルギー図ではより低い位置にあるほうが安定なので,イオン化エネルギーが小さいほど陽イオンになりやすい,ということがいえます。
これに対して,電子親和力は原子の最外殻に1個の電子が入って1価の陰イオンになるときに放出するエネルギーです。
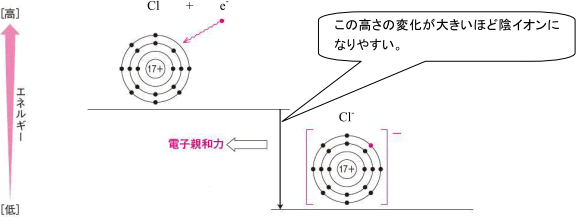
たくさんのエネルギーを放出してより低いエネルギーレベルになるほど安定な状態になるので,イオン化エネルギーとは逆に電子親和力が大きいほど陰イオンになりやすいのです。
以上のことから,イオン化エネルギーは小さいほど,電子親和力は大きいほど,それぞれ,陽イオン,陰イオンになりやすいのです。
【アドバイス】
上記のようなエネルギー図をイメージできるようにしておきましょう。
これからも進研ゼミを活用して得点を伸ばしていってください。