【化学平衡】平衡定数を求めるための反応後の量を求める過程がわかりません。
平衡定数を求める問題で,反応後の量を求めるときに出てくる表のようなものが,どのようにして出てくるのかがわかりません。作るコツなどはあるのですか?
進研ゼミからの回答
こんにちは。いただいた質問について回答します。
【質問内容】
【問題】
窒素と水素からアンモニアを生成する反応は可逆反応であり、次の化学反応式で表される。
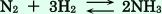
容積3.2Lの密閉容器に窒素1.0molと水素3.0molを入れ、温度を700°Cにしたところ、反応が平衡に達したときのアンモニアの物質量は12molであった。700°Cにおけるこの反応の平衡定数を有効数字2桁で求めよ。

【質問への回答】
この表は,最初からすべての数値が入っているわけではなく,化学反応の量的関係をもとにわかっている数値を順に入れて出来上がったものです。次の手順で求めていきます。
①化学反応式を書く
まずは量的関係を追跡していくためにも,化学反応式を書き出します。これは問題に与えられています。
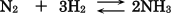
②反応前の量,変化した量,反応後の量を物質量で書き出す
(化学反応式の係数の比)=(反応した物質量の比)なので,この反応式の下にわかっている量を書き出し,
物質量の変化を追跡していきます。このとき,値がわからないところはいつたん空欄のままにしておき,ス
ペースをあけておくことがコツです。
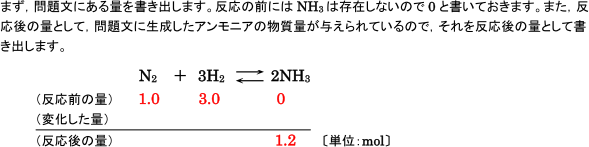
次に,反応物,生成物の反応における変化した量を考えます。反応後のアンモニアの物質量が1.2molなの
で,生成した量は1.2mol-0mol=1.2mo1となります。このことを表すため,「変化した量」のとこ
ろに,反応した量(増加した量)を符号をつけて「+1.2」と表します。
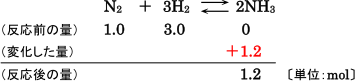
続いて,(化学反応式の係数の比)=(反応した物質量の比)から,アンモニア以外の物質量の変化を考えま
す。反応した物質量の比は

この変化した量をもとに、反応後の量を求めます。この反応は平衡状態になっているので、反応物が両方
残っていても構いません。
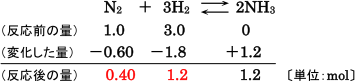
反応後の量は上の表のように求められました。後はこの量をもとに平衡定数を求める式に代入していくこと
になります。
【学習アドバイス】
化学平衡における反応の量的関係の問題では,反応が完全には進まず,反応物のすべてが残った状態の
物質量を考えることになります。化学反応において過不足が生じるときの計算と同様に,
①化学反応式を書き出し,
②反応前の量,変化した量,反応後の量を物質量で書き出す
ことにより,何がどれだけ反応したのかを順を追って考えるようにしましょう。その際,一気に答えは出ないこ
とが多いので,わからない量を明確にしたうえで,上記で説明したような手順で一つひとつわかった量を書き
出していくようにしましよう。
また,反応物の量が物質量ではなく体積〔L〕や質量〔g〕などで表されていることが多いので,表に書き出す前に
●与えられた物質の量を物質量〔mol〕に変換しておく
ことを忘れないようにしましょう。
今後も『進研ゼミ高校講座』を使って,得点を伸ばしていってくださいね。