【反応速度】結合エネルギーと活性化エネルギーの違いはなんですか?
結合エネルギーの大きさだけエネルギーを与えなくても反応が起こるのはなぜですか? 結合エネルギーと活性化エネルギーの違いについて教えてください。
進研ゼミからの回答
こんにちは。いただいた質問について回答します。
【質問内容】
結合エネルギーの大きさだけエネルギーを与えなくても反応が起こるのはなぜですか? 結合エネルギーと
活性化エネルギーの違いについて教えてください。
というご質問ですね。
【質問への回答】
化学反応は粒子の結合の組み換えと考えられます。水素とヨウ素からヨウ化水素が生成する変化は次の熱
化学方程式で表されます。
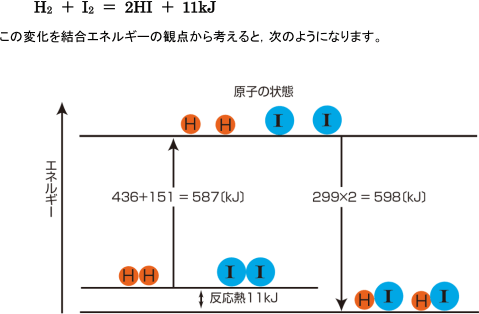
この図から,水素とヨウ素の共有結合を切るには587kJのエネルギーが必要なことがわかります。587kJの
エネルギーを与えないと反応は起こらないはずですが,実際にはこれより小さな174kJのエネルギーを与え
れば反応は起こります。
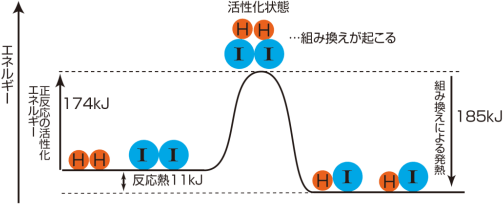
原子の結合の組み換えには,個々の原子がバラバラになる必要はありません。反応する4個の原子がゆる
く結合した「活性化状態」になれば反応は起こります。この状態になるために必要なエネルギーが「活性化エ
ネルギー」です。反応が起こるには,結合エネルギーをすべて切るための大きなエネルギーは必要ありませ
んが,活性化状態になるためのエネルギーは必要なのです。
【学習アドバイス】
熱化学方程式で結合エネルギーの計算問題を解いていると,実際の反応が起こるときにもすべての結合を
切ってバラバラにしなければ反応が起こらないと思い込んでしまうことがあります。実際には分子が衝突した
ときに活性化エネルギー以上のエネルギーをもっていれば反応が起こります。このことに注意して物質の反
応を考えていくようにしましょう。
今後も『進研ゼミ高校講座』を使って,得点を伸ばしていってくださいね。