【電池と電気分解】電気分解のイオン反応式の書き方がわかりません 。
20ページにあるユニット3の大問2の問(1)と(2)水溶液の電気分解の問題が解けません・・・。
解説を見ても理解できません。
このa~fに2e-や金属のイオンを含む式(イオン反応式?)の立て方がわかりません。
どうやって立てるのか,どこから水と水酸化物イオンが現れたのかわかりません;_;
よろしくお願いします!>_<
進研ゼミからの回答
こんにちは。
いただいた質問について回答します。
【質問の確認】
【問題】
次の表は,a~fの6種類の電気分解での水溶液中の電解質と電極を示したものである。
あとの(1),(2)に答えよ。
| 水溶液中の電解質 | 陽極 | 陰極 | |
|---|---|---|---|
| a | ヨウ化カリウム | 白金 | 白金 |
| b | 塩化銅(Ⅱ) | 炭素 |
炭素 |
| c | 塩化ナトリウム | 炭素 | 鉄 |
| d | 硫酸銅(Ⅱ) | 銅 | 銅 |
| e | 硫酸ナトリウム | 白金 | 白金 |
| f | 水酸化ナトリウム | 白金 | 白金 |
(2) 次の①,②を,それぞれ電子e-を含むイオン反応式で示せ。
① 表中eの陽極における変化
② 表中fの陰極における変化
について,イオン反応式の立て方を一緒にみていきましょう。
【解説】
以下のように,電気分解の各電極で起きる反応には優先順位があります。

◆例:問題のaについて
陽極Pt,陰極Pt,水溶液中の電解質はヨウ化カリウムです。
【陽極 酸化される優先順位】
順位1.AuやPt以外の電極は溶けてイオンになる
→ 陽極はPt
順位2.溶液中のハロゲン化物イオンは単体になる
→ 溶液はヨウ化カリウムなのでハロゲン化物イオンを含む。
よって,順位2よりイオン反応式をつくります。
【陰極 還元される優先順位】
順位1.Znよりイオン化傾向が小さい金属のイオンは単体が析出
→ カリウムはZnよりイオン化傾向が大きい。
よって,順位2よりイオン反応式をつくります。
ヨウ化カリウム水溶液には,ヨウ化カリウムのほかに水も含まれているので,水が還元されて水素が発生します。
では,問題の(2)について考えてみましょう。
①表中eの陽極における変化
陽極はPt 。
水溶液中の電解質は硫酸ナトリウムでハロゲン化物イオンを含まない。
よって,順位3よりイオン反応式をつくります。
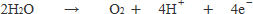
②表中fの陰極における変化
水溶液中の電解質は水酸化ナトリウムで,ナトリウムはZnよりイオン化傾向が大きいので, 順位2よりイオン反応式をつくります。
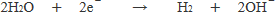
【アドバイス】
電極での反応の優先順位をしっかりと身につけておくことが大切です。
ほかの場合についても同様に優先順位にあてはめながら考えていきましょう。
これからもゼミの教材を活用し,力をつけていってください。