緩衝液とは?しくみと働きを解説【電離平衡】
緩衝液とは何でしょうか?なぜ,緩衝液に酢酸や塩基を加えてもpHの値が変化しないのか,しくみを教えてください。
進研ゼミからの回答
こんにちは。いただいた質問について回答します。
【質問内容】
緩衝液とは何でしょうか? なぜ,緩衝液に酸や塩基を加えてもpHの値が変化しないのか,
しくみを教えてください。
というご質問ですね。
【質問への回答】
「緩衝作用」は衝突や衝撃をやわらげるはたらきのことです。緩衝液の緩衝作用は,少量の酸や塩基を加え
てもその影響をやわらげ,pHをほぼ一定に保つはたらきのことです。
弱酸とその塩(または,弱塩基とその塩)の混合水溶液は緩衝液としてはたらきます。酢酸と酢酸ナトリウム
の混合水溶液を例に考えてみましょう。
酢酸は一部が電離し,平衡状態になっています。

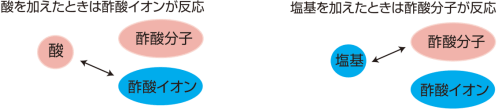
【酸を加えた場合】
混合水溶液に酸を加えると,酢酸イオンが水素イオンを受け取り,酢酸分子になる反応が起こるため,酸
性になることを抑えます。
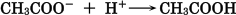
【塩基を加えた場合】
混合水溶液に塩基を加えると,酢酸分子と中和反応が起こるため,塩基性になることを抑えます。
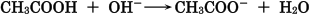
したがって,緩衝液に酸や塩基を加えてもpHはほとんど変化しません。酢酸分子と酢酸イオンが多いほど
緩衝作用の能力は大きくなります。
【学習アドバイス】
「少量の強酸や強塩基を加えても,pHがあまり変化しない」。化学反応について学習を深めていけばいくほ
ど,この緩衝液の性質は不思議に思えてきます。上で説明したように,弱酸と弱酸のイオン(または弱塩基と
弱塩基のイオン)が共存することにより,強酸や強塩基を加えた影響をやわらげることができます。このこと
を念頭において問題に取り組んでいきましょう。
今後も『進研ゼミ高校講座』を使って,得点を伸ばしていってくださいね。