結晶の析出量の求め方がわからない…計算方法を解説!
飽和溶液を冷却したときに析出する結晶の量をどのように求めればよいのかわかりません。
進研ゼミからの回答
こんにちは。いただいた質問について回答します。
【質問内容】
【問題】
水100gに対する硝酸カリウムの溶解度は,30℃で45,70℃で135である。70℃の飽和水溶液100gを
30℃に冷却したとき,析出する結晶は何gか。
という問題について,析出量を求める手順と考え方についてのご質問ですね。
【質問への回答】
一定量の溶媒に溶ける溶質の量には限界があり,限界まで溶質が溶けた溶液が飽和溶液です。
一般に,固体は温度が高いほど溶解度は大きく,より多くの溶質を溶かすことができます。
また,高温の飽和溶液を冷却すると,溶解度を超えた分の溶質が結晶となって析出します。飽和溶液を冷却
して結晶が析出しても,溶媒の量は変化しません(無水物の場合)。
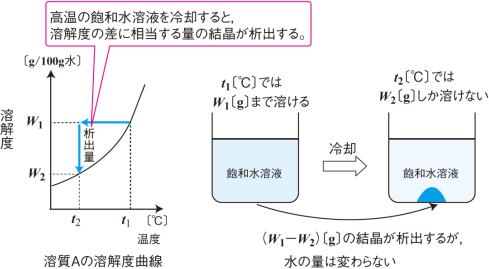
では結晶の析出量の計算について,【問題】を解いて考えてみましょう。
(考え方)
まず,水100gでつくった70℃の飽和水溶液が30℃に冷却されたとき,何gの結晶が析出するかを求め
てみましょう。
70℃で135g溶解している飽和水溶液を30℃まで冷却すると,30℃では45gしか溶解できないので
135-45=90[g]析出します。
また,70℃のときの飽和水溶液は100+135=235[g]です。
以上より,
「70℃→30℃の冷却では,飽和水溶液235gにつき,90g析出する」
ことがわかりました。この割合を用いて,飽和水溶液100gから析出する結晶の質量をx[g]としたとき,次式
が成り立ちます。
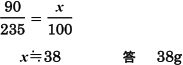
【学習アドバイス】
結晶の析出量は,質量の値がいろいろと出てきて複雑に感じます。しかし,溶液,溶質,溶媒の質量を区別
し,析出量に関する比例式を立てることができれば,あとは計算を実行するだけとなります。その計算も,多
くの場合整数で求められることは少なく計算にてこずることがありますが,いくつか問題を解いて慣れておき
ましょう。
今後も『進研ゼミ高校講座』を使って,得点を伸ばしていってくださいね。